1. Atomok mindenhol
Hogyha egy mondatban kéne megfogalmazni, hogy mi a legfontosabb természeti törvény, talán azt mondanám, hogy az, hogy „minden atomokból” áll. De komolyan, az összes szilárd tárgy, minden folyadék, és gáz atomokból áll.
Képzeljük csak el a vizet. Csak egy félcentis, 5mm-es vízcseppet. Folyamatos egybefüggő víztömegnek tűnik. De nézzük csak meg közelebbről, mondjuk úgy 1000-szeres nagyításban. Ilyenkor ez a vízcsepp akkora, mint egy ház. Ilyenkor már láthatunk benne pici úszó dolgokat, például porszemeket, polleneket, baktériumokat és nagyobb egysejtűeket. További 1000-szeres nagyítás után a vízcsepp már 5km-es, akkora mint kisebb város. Ekkor már látható, hogy valamik izegnek mozognak ott, de még nem látjuk pontosan, hogy mik. További 100-szoros nagyításban, ekkor már a vízcseppünk 500km-es, akkora mint egy ország, már 1 centisnek látszódnak a vízmolekulák. Egy vízmolekula mérete $2 \cdot 10^{-10}$ méter (0,2 nanométer).
Ezek a vízmolekulák folyamatos mozgásban vannak, hisz nincs semmi, ami megállíthatná őket, nincs légellenállás, hisz a levegő molekulák is nagyok hozzájuk képest. Közöttük súrlódás sincsen, ezért a vízmolekulák folyamatos mozgásban vannak. Ez a mozgás egyébként nagyon gyors, a vízmolekulák szobahőmérsékleten kb. 600 m/s sebességgel fészkelődnek a folyadékban. Tulajdonképpen ez a mozgás az, amit hőmérsékletként érzékelünk. Ha gyorsabban mozognak a molekulák, akkor magasabb a hőmérséklet. Ha lassabban, akkor alacsonyabb, tehát hidegebb az anyag. Minél lassabban mozognak a részecskék, annál hidegebb az anyag, de megállítani nem lehet őket. És még vonzzák is egymást bizonyos mértékben, azonban ha túl közel kerülnek egymáshoz, már taszítják egymást. A folyadékokban olyan közel vannak egymáshoz, hogy közelebb már nem igazán tudnak kerülni, ebből adódóan a folyadékok gyakorlatilag összenyomhatatlanok. Ha a vizet felmelegítjük, akkor benne a vízmolekulák mozgása olyan gyors lesz, hogy szétszélednek: a víz felforr. A gáz halmazállapotú víz, a gőz, molekulái szabadon repkednek, egyenes vonalban addig, amíg egy másik molekulába vagy a tárolóedény falába nem ütköznek.

A folyadék részecskéi sűrűn egymás hegyén hátán gördülnek, közelebb már nem is kerülhetnének, ezért a folyadékok gyakorlatilag összenyomhatatlanok.
A gáz molekulái a tárolóedény falának folyton nekiütköznek és lepattannak róla. Ez a sok pici rúgás együttese egy folyamatos erőhatást eredményez, ez az, amit úgy hívunk, hogy a gáz nyomása. Ha többen ütögetik az edény falát azonos hőmérsékleten, a nyomás nagyobb. Hogyha ugyanannyi molekula ütögeti az edény falát, de nagyobb hőmérsékleten, akkor is nagyobb a nyomás.

A gázok részecskéi között van hely, ezért van lehetőség arra, hogy kisebb helyre nyomjuk össze gázt. A gáz összenyomható.
Talán ismerős lehet az is, hogyha a biciklipumpának az alja fel szokott melegedni, hogyha sokáig pumpálunk vele. Hogyha egy dugattyúval összenyomjuk a gázt, akkor a dugattyúnak pattanó gázmolekulák nagyobb sebességgel pattannak vissza, hiszen a dugattyú is mozog a visszapattanás irányába. Ez azt eredményezi, hogy a gáz melegebb lesz, és ezzel együtt a nyomása is megnő. De ennek a fordítottja is igaz, ha egy gázt hagyunk kitágulni azzal, hogy a dugattyút kihúzzuk a gázmolekulák lassabban pattannak vissza a dugattyúról, és a gáz így lehűl.
Amennyiben lehűtjük a vizet az megfagy. Ennek az oka az, hogy a vízmolekulák a hőmérséklet csökkenésével lelassulnak. Elég lassúak lesznek ahhoz, hogy a molekula pozitív vége, ahol a hidrogén atomok vannak, odaforduljon egy másik molekula negatívabb végéhez, ahol az oxigén atomok vannak. Ennek az eredménye pedig az lesz, hogy ezek a részecskék egy szellős kristályrácsba rendeződnek, ez az oka annak, hogy a víz kitágul, amikor fagy, és képes akár a csöveket is szétfeszíteni. A jégnek is van hőmérséklete, a molekulák továbbra sem állnak meg, az így kapott kristályrácsban rezegnek, a mozgásuk továbbra is a hőmérséklet meghatározója. Ha a jeget újra elkezdjük melegíteni a molekulák rezgése elég nagy lesz ahhoz, hogy kiszakadjanak a kristályrácsból és újra elgördüljenek egymáson, a jég így olvad meg.
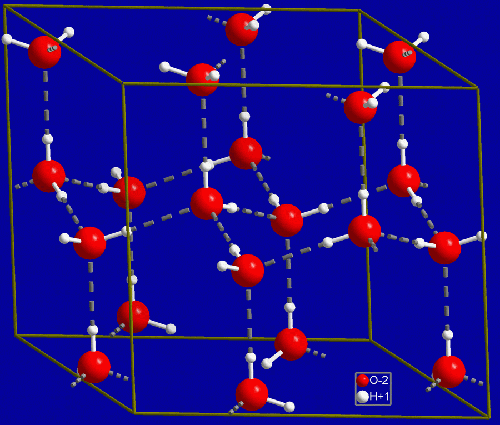
A jég kristályban a vízmolekulák szellősen helyezkednek el, ezért azonos tömegű jég térfogata nagyobb, mint a vízé. (Forrás)
Vannak azonban anyagok, amelyek esetén a molekulák, amint kiszakadnak a kristályrácsból nyomban tovarepülnek, és nem alkotnak folyadékot, hanem egyből gázt. Ilyen anyag a fagyott szén-dioxid (hétköznapi nevén a szárazjég), amely nem olvad meg, hanem egyszerűen eltűnik, ezt a szilárdból egyből gázzá alakulást nevezzük szublimációnak. Ahogy a gáz ütögeti az edény falát, és ez mérhető nyomást okoz, úgy folyadékok belsejében is a molekulák mozgása egyfajta belső nyomást, ún. gőznyomást, kelt. Ha a külső légköri nyomás nagyobb, mint ez a gőznyomás, akkor a külső levegő nem fogja engedni, hogy a folyadék részecskéi szétszéledjenek, és összetartja a folyadékot. Ha azonban a hőmérsékletet növeljük, akkor a részecskék mozgása megnő, és előbb vagy utóbb el fogja érni a külső légköri nyomást. Ekkor a folyadék felforr, és szétesik. Azonban nem csak melegítéssel lehet egy folyadékot felforralni. A külső légnyomás csökkentésével szintén meg lehet oldani, hogy a folyadék belső gőznyomása nagyobb legyen, mint a külső légnyomás. Így akár szobahőmérsékleten is felforralható a víz, ha kiszívjuk a levegőt felőle. A szárazjég esetén pedig az történik, hogy a szublimációs pontján (-78°C fokon) a folyékony széndioxid gőznyomása már nagyobb, mint a légköri nyomás. Ezért a szárazjég a folyékony halmazállapot kihagyásával azonnal gáz halmazállapotba lép, olvadás helyett szublimál.
Fizikai kölcsönhatások az atomok között
Az előző szakaszban elmagyaráztam, hogy a 3 fő halmazállapotot és az átmeneteket, hogyan lehet megmagyarázni az atomok segítségével. Ebben a részben leírom, hogy hogyan lehet megmagyarázni egyes fizikai folyamatokat az atomok segítségével.
Ha felmossuk a padlót, akkor a mosás után a víz pár perc múlva eltűnik a padlóról, megszárad. Ennek az oka az, hogy a folyadékok felszínén mindig vannak olyan molekulák amelyek gyorsabbak a többinél, ezeknek így mindig van elég energiájuk ahhoz, hogy elhagyják a folyadékot. A víz ily módon párolog. Így összességében a gyorsabb molekulák elhagyják a folyadékot, míg a maradék folyadékban csak a lassabb molekulák maradnak meg: ennek az eredménye lesz az, hogy a párolgó folyadék lehűl. De ez az esemény fordítva is lezajlik: a molekulák nem csak elhagyják vizet, hanem lassabbak vissza is csatlakoznak a vízbe, így ez a folyamat oda vissza megtörténik. Ezért van az, hogyha fúj a szél, akkor a ruháink gyorsabban száradnak: a szél elfújja a levált vízmolekulákat, így a víz inkább megy elfelé, mint visszafelé. Egy lezárt edényben a folyadékról folyamatosan lépnek ki a molekulák, és azonos ütemben térnek is vissza, ez egy dinamikus egyensúly. Így egy lezárt edényből a folyadék nem szokott eltűnni.

A folyadék tetejéről a gyorsabb részecskéknak van lehetősége elrepülni, a folyamat során a lassabbak maradnak hátra, így a folyadék lehül - extrém esetben akár meg is fagyhat.
A halak a vízből felveszik a benne oldott oxigént. Ennek az oka az, hogy nem csak vízmolekulák kerülhetnek vissza a folyadékba, belekeveredhetnek a levegőből a nitrogén és az oxigén molekulák is. Ily módon a folyadékok feloldják a gázokat. Ez is egy olyan folyamat, amely oda-vissza történik, ha van a folyadék felett levegő, akkor a folyadékba belekeveredik a levegő, és egyben fel is szabadul belőle. Ezért szokták a folyadékokat gáztalanítani oly módon, hogy vákuumba helyezik azt, ugyanis így a gázok inkább kilépnek belőle.
Ha a vízbe sót szórunk, akkor az feloldódik. A só nátriumból és klórból áll (nátrium-klorid), ezeknek az atomjai nagyobbak, mint a hidrogén és az oxigén, és jóval szellősebben kötődnek egymáshoz. Korábban említettem, hogy a vízmolekulák a hidrogén felé pozitív, az oxigén felé negatív töltésűek. A sóban pedig a klór a negatív, és a nátrium a pozitív töltésű. Így a vízmolekulák a pozitív hidrogén oldalukkal a negatív klór felé fordulva körülveszik azokat; míg a negatív oxigén oldalukkal körülveszik a pozitív nátrium atomokat. Aztán addig izegnek mozognak, míg ki nem tépik őket a kristályrácsból. Természetesen ezt a folyamatot nem lehet a végtelenségig folytatni, legjobb esetben is előbb vagy utóbb minden víz molekula körbe fog egy nátrium vagy klór atomot, így többet már nem tudnak kitépni a kristályból és az oldat telített lesz. Ekkor létrejön egy dinamikus egyensúly, melyben azonos ütemben kötődnek vissza a nátrium és klór atomok, mint amilyenben lejönnek. Ha az oldatot felmelegítjük, akkor még több sót lehet feloldani benne. Ez azért van, mert akkor a vízmolekulák is gyorsabban mozognak, és jóval hajlamosabbak kirángatni az atomokat a kristályrácsból. Ha a sóoldatot lehűtjük, akkor az oldott anyagból kikristályosodik a só, mert ha lassabbak a vízmolekulák, akkor kevésbé tudják megtartani a sót, így a nátrium és a klór atomok elszabadulnak és összekötődnek, így a feloldódás ellentéte a kikristályosodás vagy kicsapódás.
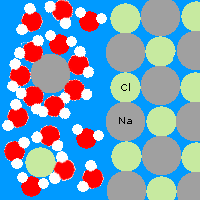
A sok kis víz molekulának van elég ereje, hogy kitépje az ionokat a sókristályból. Így oldódnak fel a szilárd anyagok a vízben.
Kémiai kölcsönhatások
Az előző részben leírtam pár fizikai kölcsönhatást az anyagok részecskéi között. Azonban a kölcsönhatásokban a résztvevők nem cseréltek atomokat egymás között, a víz víz maradt, a sót is csak szét szedtük ionjaira. Azonban vannak olyan kölcsönhatások is, amelyek során a résztvevők atomokat is cserélnek egymással, az eredményben pedig új fajta anyag jön létre. Az ilyen reakciók a kémiai reakciók.
Ha meggyújtjuk a szenet, elég. A szén és a levegő oxigénje egyesül, és szén-dioxid keletkezik. A tiszta szén (grafit formájában) egy fekete anyag, az oxigén pedig egy gáz, amit belélegzünk, és az életünkhöz nélkülözhetetlen. A szén-dioxid szintén egy gáz, amely nehezebb a levegőnél, és hajlamos kiszorítani az oxigént, ezért a borospincékben, amikor a bor erjedése során szén-dioxid keletkezik, akár meg is fulladhat az ember, hogyha nem vigyáz. Itt különböző kémiai elemek atomjai kapcsolódnak össze egymással. A szén (esetünkben grafitot vagy gyémántot jelent) atomjai nagy erővel össze vannak kapcsolódva, ezért a szén atomjait nehéz szétszedni. A szén 3642°C fokon kezd szublimálni légköri nyomáson. Habár az atomjai maguktól csak nehezen válnak le a kristályból, a légkörben lévő oxigén jobban szeret kötődni hozzá, mint a másik oxigénhez. Viszont az atomok taszítják egymást, hogyha közel kerülnek, ezért a szénnek és/vagy az oxigénnek viszonylag nagy sebességgel kell mozognia és ütköznie, hogy igazán közel kerüljenek egymáshoz. Ha azonban közel kerülnek egymáshoz, a kémiai reakció megtörténik, ekkor nagy energia szabadul fel. A keletkező szén-monoxid nagy sebességgel repül tova, és ütközik a többi szénatommal, és felgyorsítja őket is. Így aztán a többi szénatom is készen áll majd arra, hogy oxigénnel egyesüljön, amely újabb gyors molekulákat eredményez. Ez az égés folyamata. Később ezeknek a szén-monoxid molekulák újabb oxigénnel ütközve alakulnak majd szén-dioxiddá, melynek során még nagyobb sebességet nyernek.

Amikor szén oxigénnel egyesül, nagy sebességgel lökődik ki a szén kristályból, miután összeütközött más szén atomokkal is, ezzel tovább melegítve a kristályt, és fenntartva az égést.
Szóval akármerre is nézünk, legyen az egy felhő az égen, vagy amikor a levest fújjuk, hogy hüljün, mindenhol olyan jelenségekbe botlunk, amelyek azt igazolják, hogy az anyagok atomokból és molekulákból állnak. Így ha a legfontosabb természeti törvényt kellene 1 mondatban összefoglalni ez lenne az.